目的是发展对以下概念的基本理解:万博世界杯狂欢
- 热力学能和热力学第一定律
- 系统的循环和任意过程
- 可逆性与不可逆性
- 熵和焓
- 热力学第二定律
热力学能和热力学第一定律
当系统内分子的能量与系统的性质相联系时,它被称为内能(u)。
能量既不能被创造也不能被破坏,基于这一基本的系统,当能量越过系统边界时,内部能量(u)就会发生变化。
因此,当热/功与系统相互作用时,热力学第一定律可以表述如下。

在上式中,u是单位质量的内能,q和w分别是单位质量的热量和功。上式采用的符号约定为:
dq > 0(认为是正的)根对系统的热传递
dq < 0(认为是负的)从系统传递出的热dw > 0(认为是正的)从系统所做的功
dw < 0(认为是负的)根对系统所做的功
系统的循环任意过程
热力学第一定律的重要形式之一是当
我们对循环过程对上述方程进行积分。
一种被称为处于循环过程中的系统,在经历热/功的随机变化后恢复到原始状态。
思考要点有:
- 对任何国家财产的积分都是其界限之差。
- 最终态与原始态相同,系统的热力学能没有变化。
因此,当
上式中热力学能的初态和终态分别用i和f表示,将其代入式(1)则
式(2)表示系统做的所有功或系统做的净功等于系统传递的所有热量的积分。工程热力学进一步探索系统和过程的概念。
系统的任意过程
它是热力学第一定律的结果,如果一个系统包含一个任意的过程,它与方程(1)有关。
式中q和w分别为过程的净传热量和净做功,uf和ui分别为内能(u)的最终值和初值。在一个刚性孤立绝热系统(w = 0, q = 0)中,其热力学能(u)保持不变。然后由循环过程的eq(2)。
可逆性与不可逆性
一个系统正在经历一个过程,当它的初始状态变为最终状态。像压强、体积、焓、温度、熵等性质在热力学过程中发生变化。热力学第二定律将这些过程分为两类
- 理想或可逆过程
- 自然或不可逆过程
如果温度(t)和压力(p)的变化是无穷小的,系统正在进行一个过程,那么这个过程可以被称为接近平衡状态或接近可逆性。
如果原始状态以相反的方向重新存储,则这个过程称为内部可逆的。
这个过程称为外部可逆环境伴随的变化也可以顺次逆转。
可逆过程是指内部和外部都可逆的过程。
为了衡量一个真实过程的成功程度,专业人士使用可逆过程作为比较的手段,通过降低损失,使真实和实际的过程更接近可逆性,从而提高过程的效率。
不可逆性
当实际过程不能满足可逆性要求时,称为不可逆过程。
在不可逆过程中,系统和周围环境的初始状态不能从最终状态恢复到初始状态。系统的熵在不可逆过程中急剧增大,其值不能从最终值恢复到初始值。
不可逆性存在于压力、成分、温度、主要由传热引起的成分、固液摩擦、化学反应等方面。专业人士正忙于努力降低过程和机制中不可逆性的影响。
熵和焓
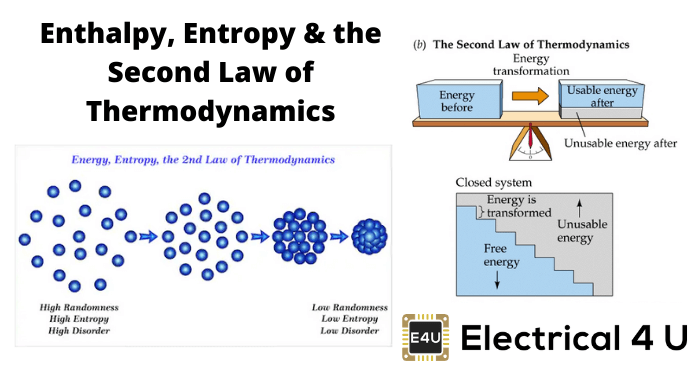
像热力学能一样,熵和焓也是热力学性质。熵用符号s和kJ/kg-K中熵的变化δs表示。熵是一种无序状态。熵是热力学第二定律的主题,它描述了系统和周围环境相对于宇宙的熵的变化。
熵的定义是在一个可逆的热力学路径中,热传递与绝对温度的比值。
在那里,问牧师表示沿可逆路径的热传递。
焓(h)是状态性质,定义为:
式中,h为比焓,u为比内能,v为比体积,p为压强。
从方程(1)
因此
对eq(4)进行微分,代入上式,则
上述两个方程均与热力学能和体积的变化引起的可逆过程的熵变化有关,而与焓和压的变化有关。
由于这两个方程中的所有量都是状态性质,因此熵也是一种热力学性质。
热力学第二定律
热力学第二定律以描述宇宙的极限而闻名。2nd法律更多的是处理无效率、衰退和退化。
我们在日常生活中所做的活动本质上是低效和不可逆的过程。
热力学第二定律可以更方便地用熵表示:
熵定义为系统熵的无限小变化(dS),是进入封闭系统的实测热量(dqrev)与传热发生点的公共温度(T)的比值。
热力学第二定律指出“熵的变化被认为是非负的”。
或
宇宙能量正逐渐走向无序状态