在详细说明这个主题之前,即电池充电和放电,我们将首先尝试了解什么是氧化和减少。因为,电池由于氧化和还原反应而被排出或充电。
为了理解氧化理论和减少,我们可以直接进入化学反应的一个例子。让我们考虑锌金属和氯之间的反应。
在上述反应中,锌(Zn)首先放弃两电子并变为正离子。
这里,每氯原子接受一个电子并变为负离子。
现在,这两个相反的电荷的离子在一起结合在一起,形成氯化锌(ZnCl2)
在这种反应中作为锌放弃电子,它被氧化,氯接受电子,因此降低。
如原子放置电子,其氧化数增加。这里,在我们的示例中,随着氧化数的增加,随着氧化数增加,氧化锌的氧化数变为+ 2,这部分反应被称为氧化反应。另一方面,当一个原子接受电子,它的负氧化数量增加,这意味着原子的氧化数在零参考方面减小。随着氧化数减少或减少,该部分的反应称为还原。
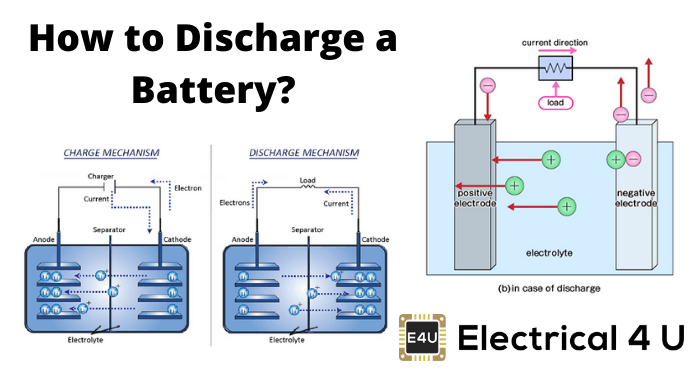
电池卸料
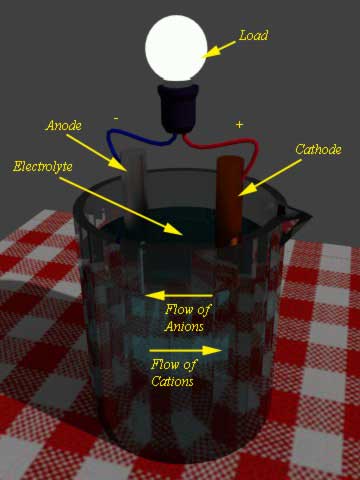
在电池中,有两个电极浸入电解质中。当外部负载连接到这两个电极时,在一个电极中发生氧化反应,并且在其他电极中发生同时发生的时间。
发生氧化的电极,电子的数量变得过量。该电极称为负电极或阳极。
另一方面电池卸料,另一个电极涉及还原反应。该电极称为阴极。阳极中过量的电子,现在通过外部负载流到阴极。在阴极中,接受这些电子,即阴极材料参与还原反应。
现在阳极氧化反应的产物是正离子或阳离子,其将通过电解质流到阴极,同时,阴极在阴极下的还原反应是负离子或阴离子,它将通过电解质流向阳极。
让我们采取一个实用的例子,以说明电池的放电。让我们考虑镍镉电池。这里,镉是阳极或负电极。在阳极镉金属的氧化过程中与OH反应-离子并释放两个电子并成为氢氧化镉。
该电池的阴极由羟基氧化镍或简单的氧化镍制成。在阴极中,进行还原反应发生并且由于该还原反应,通过接受电子将羟基氧化镍成为氢氧化镍。
电池充电
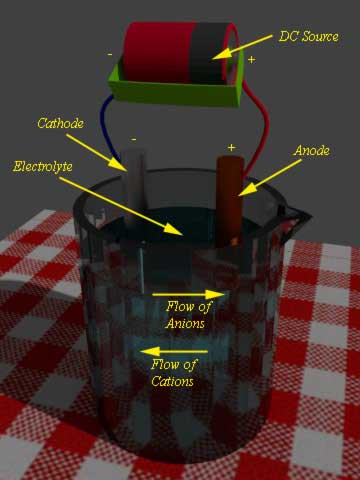
期间电池充电,外部直流源应用于电池。DC源的负极端子连接到负极板或阳极的电池和源的正端子连接到电池的正极板或阴极。
现在,由于外部直流源,电子将注入阳极。还原反应在阳极而不是阴极中进行。实际上在放电电池的情况下,还原反应在阴极处进行。由于这种还原反应,当电池未放电时,阳极材料将重新获得电子并返回其先前的状态。
由于DC源的正末端连接到阴极,因此该电极的电子将被该DC源的正末端吸引。随着结果,在阴极和阴极材料处发生氧化反应,其恢复其先前的状态(当它没有排出时)。这是电池充电的总体基础。
现在涉及可充电镍镉电池的一个例子。期间电池充电,充电器DC源的负极和正极端子连接到电池的负极和正极。在这里,在阳极,由于来自DC阴性末端的电子存在,还原发生了由于哪种氢氧化镉再次成为排镉并释放氢氧化物离子(OH-)到电解质。
在阴极或正电极,由于氧化,氢氧化镍变为镍羟基氧化物释放在电解质溶液中的水。
期间电池充电,二次电池转向其原始的带电状态,并准备进一步放电电池。