在1808年,着名的英国化学家,物理学家和气象学家John Dalton发表了他的理论原子。当时,道尔顿的理论迅速解开了许多无法解释的化学现象。因此,该理论成为化学的理论基础。道尔顿原子理论的假设如下。
- 一切物质都是由称为原子的小的、不可分的、不可破坏的粒子组成的。
- 所有相同元素的所有原子具有相同的性质,但与其他元素的原子不同。
- 不同元素的原子组合在一起形成化合物。
- 化学反应只不过是这些原子的重新排列。
- 无法通过任何手段创造或摧毁原子。
道尔顿的理论有一些缺陷,比如;今天我们知道原子是可以毁灭的。同样,相同元素的某些原子的质量(同位素)也不同。这一理论也无法解释同素异形体的存在。
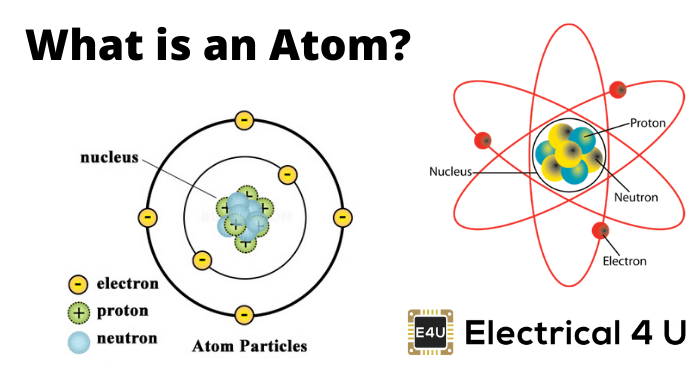
但是在现代原子概念的基础上是结合了这些优点的Rutherford的原子模型和Bohr的原子模型。所有物质都由原子组成。所有原子包括,
- 核
- 电子
原子核心
nucleus位于原子的中心。核的直径为整个原子直径的1/10000。几乎全质量的原子集中在其核中。核心本身由两种粒子组成,
- 质子
- 中子
质子
质子是带正电荷的颗粒。每个质子上的充电是1.6×10-19库仑。原子核中的质子的数量代表原子数的原子。
中子
中子没有电荷。意思是,中子是电中性颗粒。每个中子的质量等于质子的质量。
由于存在带正电的质子,原子核是带正电的。在任何物质中,原子的重量和放射性性质都与原子核有关。
电子
电子是存在于原子中的带负电荷的粒子。每个电子电荷为-1.6×10- 19库仑。这些电子围绕着原子核。下面列出并解释了一些关于原子中电子的事实,
- 如果原子具有相同数量的质子和电子,则原子是电中性,因为电子的负电荷中和质子的正电荷。
- 电子在壳层(也称为轨道)中绕着原子核旋转。
- 通过带正电荷的核,吸引力的吸引力排出带负电的电子。这种吸引力的力量适用于核周围电子革命所需的向量。
- 靠近原子核的电子与原子核紧密地结合在一起,因此把这些电子从原子中拉出来比把远离原子核的电子拉出来要困难得多。
- 铝原子的结构如下图所示 -

- 把电子移出它的轨道需要一定的能量。将电子从第一轨道移走所需的能量,比将电子从外层轨道移走所需的能量要大得多。这是由于原子核在第一轨道上对电子的引力比在外层轨道上对电子的引力大得多的缘故。同样,将电子从第二轨道移出所需要的能量比第一轨道要小,比第三轨道要大。因此,我们可以说,轨道上的电子与一定数量的能量有关。因此轨道或壳层也被称为能级。
- 能级用K、L、M、N等字母表示。其中,K是离原子核最近的轨道,具有最低的能级。相反,最外层的轨道具有最高的能量级别。
- '2N的任何能级中的最大电子数2',其中,n是整数,表示“主量子数”。对于不同的能量水平,下表中给出的“N”和最大电子数量
| SL。没有。 | 能量水平或轨道(壳) | 主量子数n | 最大电子数(2n2) |
| 1 | K. | 1 | 2×12= 2 |
| 2 | L. | 2 | 2×22= 8. |
| 3. | m | 3. | 2×32= 18. |
| 4. | N | 4. | 2×4.2= 32. |
- 上式(2n2)用于确定任何外壳中的最大电子数,具有一些限制。最外壳(最高能级)中的电子数不能超过8.例如,让我们考虑钙的原子,它在其核周围具有20个电子。根据上述规则的公式i.E.2N2,电子分布将在k电平中的2个电子,L电平8个电子,并且存在10个电子。但是,外部能量水平中的电子不能超过8.因此,M级中将存在8个电子,并且平衡2电子将进入下一个能级I.E.2电子将达到n水平。钙原子的电子配置如下图所示 -

- 最外层能级的电子称为“价电子”。“价电子”的最大可能数目是8。如果最外层轨道上的电子数是8,原子就会变得稳定。这种材料的原子在其最外层(轨道)有8个电子,不会与其他材料反应。惰性气体,如氦气、氖气、氩气、氪气等,已经完全充满了外壳,因此不会与其他物质发生反应。
- 原子的“价电子”与细胞核松散地束缚,并且可以通过不同的方法来释放/除去通过加热,通过施加电压等。
- “价电子”形成将材料原子保持在一起的键合。材料的大部分性质由这些材料中的这些键决定。
- 每个主壳层(能级)又细分为子壳层。这些亚层叫做轨道。这些亚壳层/轨道分别用s、p、d、f等表示量子数,L = 0,1,2,3,4,......(n-1)等。任何主壳中的子壳数等于主量子数为'n'。通过添加子壳的电子容量,可以确定任何主壳的电子容量。子壳的最大电子容量由2(2L +1)的公式控制。子壳的容量在下表中给出 -
| SL。没有。 | 子壳 | 量子数(左) | 子壳的电子容量 2 (2 l + 1) |
| 1 | S. | 0. | 2(2×0 + 1)= 2 |
| 2 | P. | 1 | 2(2×1 + 1)= 6 |
| 3. | D. | 2 | 2(2×2 + 1)= 10 |
| 4. | F | 3. | 2(2×3 + 1)= 14 |
- 第一个壳I.E.K壳将具有主要量子数1和一个轨道,因此S的轨道表示为1S。
- 第二壳即,L壳将具有主要量子数2,并且将具有一个s和一个p轨道,它们分别表示为2s和2p。
- 第三壳I.E.M壳将具有主量子数3并且将具有一个S,一个p和一个d轨道,它们分别表示为3s,3p和3d等。
- 在这里,我们还有另一件事要记住,S轨道有一个亚孔,每个亚轨道可以包含最大两个电子。p orbital有3个子孔和d orbital有5个子孔。
- 能量较低的亚轨道先被填满,然后是能量较高的亚轨道。在较低轨道的轨道被填满之前没有任何机会填满更高的轨道或亚轨道。
如果我们经过下面的示例,它将很清楚我们。
具有13个电子的铝的原子结构
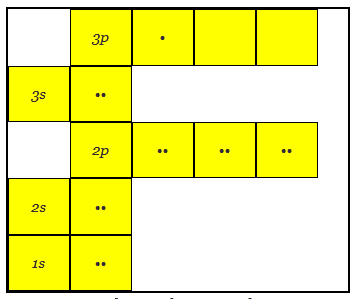
铜的原子结构有29个电子
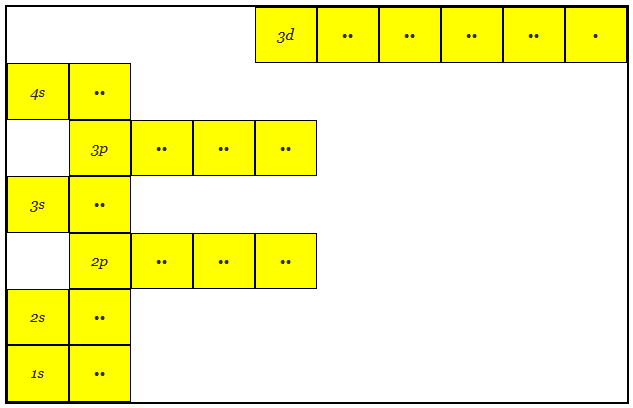
这里可以看到,3d轨道的能级高于4s轨道
银的原子结构有47个电子
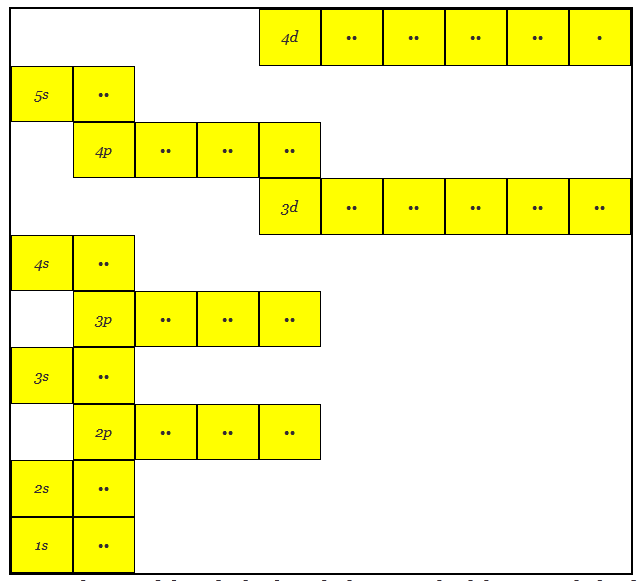
这里可以注意到,3D轨道在较高的能量水平上,类似于4D轨道在较高的能量水平上比5s类似。
现代原子理论
现代原子理论只是比道尔顿的理论进化了一点点。现代原子理论也被称为量子理论。这个概念波粒子二元性在这里出现了。它说,被认为是粒子的电子有时会表现得像波一样。原子的原子核被概率云包围着。这些云是最有可能存在电子的地方。这些云的大小和形状可以用波的方程来计算。