电解
在理解之前电解原理,我们应该知道什么是电解质或电解质的定义
电解质的定义
电解质是这样的化学物质原子通过离子键紧密结合在一起,但是当我们将其溶解在水中时,其分子将其分成阳性和负离子。带正电荷的离子称为阳离子,而带负电离子的离子称为阴离子。两个阳离子和阴离子在解决方案中自由移动。
电解原理
在离子键中,一个原子失去了其价电子和另一个原子获得电子。结果,一个原子变得带正电的离子,另一个原子变为负离子。由于相反的电荷均彼此吸引并在它们之间形成键合,称为离子键。在离子键中,作用在离子之间的力是与培养基的介电常数成反比的库仑力。水的相对介电常数为80,20O.C.SO,当任何离子键合的化学物质溶解在水中时,离子之间的键合强度变得更弱,因此其分子在溶液中自由移动的阳离子和阴离子分裂。

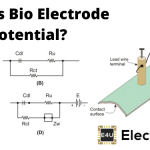
现在我们将浸入解决方案中的两个金属棒,我们将申请电势差由a外部的杆之间电池。

这些部分浸渍的棒在技术上是电极的。连接与电池负极端子的电极称为阴极,与电池的正端子连接的电极称为阳极。通过阴极吸引可自由移动的带电阳离子,并且通过阳极吸引带负电的阴离子。在阴极中,阳性阳离子从负阴极和阳极中取电子,负阴离子给电子给正极阳极。为了分别在阴极和阳极中连续地进行电子,必须在电解的外部电路中存在电子流。这意味着,当前继续循环通过电池,电解和电极产生的闭环围绕。这是最基本的电解原理。
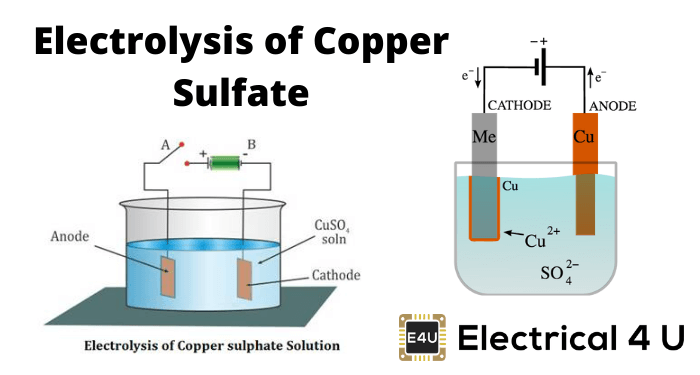
硫酸铜电解
每当硫酸铜或尖食4.加入水中,溶解在水中。作为Cuso.4.是电解质,它分裂成铜+ +(阳离子)等4.- -(阴离子)离子并在溶液中自由移动。
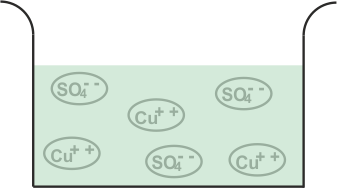
现在我们将浸入该溶液中的两个铜电极。

CU+ +离子(阳离子)朝向阴极吸引。连接到电池的负端子的电极。在达到阴极上,每个CU+ +离子将从其上取电子并变成中性铜原子。

同样是这样的4.- -(阴离子)离子将被阳极I.。电极连接到电池的正极端子。普通4.- -离子将转向阳极,在那里他们放弃两个电子并变成如此4.激进。

但是因为所以4.激进不能存在于电中性状态下,它将攻击铜阳极并形成硫酸铜。

在上述过程中,在采用电子后,中性铜原子被沉积在阴极上。同时,所以4.用铜阳极反应并成为Cuso4.但在水中,它不能作为单个分子而不是那个cuso存在4.将分成铜+ +,所以4.- -并溶解在水中。所以可以得出结论,在用铜电极电解的硫酸铜期间,铜沉积在阴极上,并从阳极中除去相同的铜。如果期间,则硫酸铜电解,我们使用碳电极代替铜或其他金属电极,然后电解反应会有点不同。实际上是如此4.不能与碳反应,在这种情况下也是如此4.将与溶液的水反应,并形成硫酸和释放氧气。

上述过程称为电解。