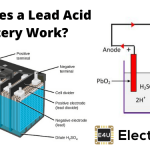
电池工作原理
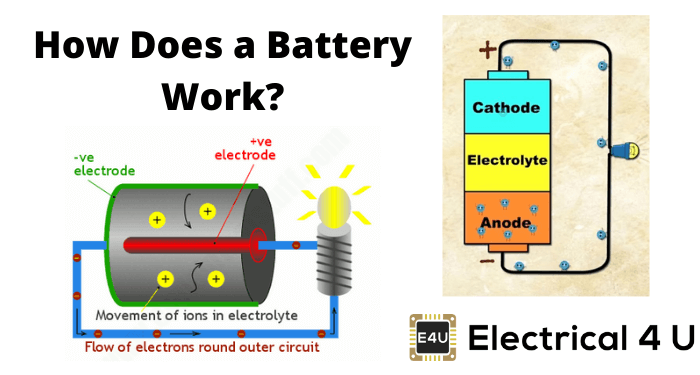
电池适用于金属电解质的氧化和还原反应。当两个不同的金属物质称为电极置于稀释的电解质中,氧化和还原反应分别在电极中进行,这取决于电极的金属的电子亲和力。由于氧化反应的结果,一个电极被带负电称为阴极,并且由于还原反应,另一个电极得到正电荷称为阳极。
阴极形成负极端子,而阳极形成电池的正极端子。理解这一点电池基本原理首先,我们应该对电解质和电子亲和力有一些基本的概念。实际上,当两种不同的金属浸没在电解液中,就会有潜在差异在这些金属之间产生。
人们发现,当某些特定的化合物加入水中时,它们会溶解并产生负离子和正离子。这种化合物被称为电解质。最常见的电解质是几乎所有种类的盐、酸、碱等。中性原子接受电子时所释放的能量称为电子亲和力。随着原子结构对于不同的材料是不同的,不同的材料的电子亲和力也会不同。
如果两种不同的金属浸泡在同一电解质溶液中,其中一种会获得电子,另一种会释放电子。哪种金属(或金属化合物)会得到电子,哪种会失去电子,取决于这些金属的电子亲和力。低电子亲和力的金属会从电解质溶液的负离子中获得电子。
另一方面,具有高电子亲和力的金属会释放电子,这些电子出来进入电解质溶液,加入到溶液的正离子中。这样,其中一种金属获得电子,另一种失去电子。结果,这两种金属之间的电子浓度会有差异。
电子浓度的这种差异导致金属之间产生的电势差。这种电势差或EMF可以用作电压来源在任何电子产品或电路。这是一般的和基本的电池原理这是电池如何工作。
所有电池单元只能基于这种基本原理。让我们一个接一个地讨论一个。正如我们之前所说的那样,Alessandro Volta开发了第一个电池单元,这种细胞普遍称为简单伏打电池。可以很容易地创建这种类型的简单单元格。服用一个容器并用稀释的硫酸作为电解质填充。现在我们将一个锌和一个铜棒浸入溶液中,并通过电负载在外部将它们连接。现在你的简单Voltaic细胞完成。电流将开始流过外部负载。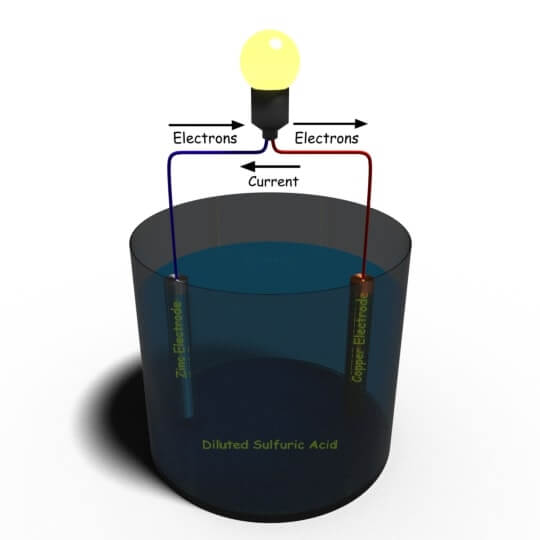
稀释的硫酸中的锌放大电子如下: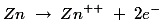
这些锌+ +离子进入电解质,每一个锌离子+ +离子在杆中留下两个电子。作为上述氧化反应的结果,锌电极被带负电,因此用作阴极。因此,Zn的浓度+ +电解质中阴极附近的离子增加。
根据电解质的性质,稀释后的硫酸和水已经解离为正水合氢离子和负硫酸根离子,如下所示: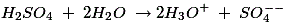
由于高浓度的Zn+ +在阴极附近的离子,h3.O+离子朝向铜电极排斥,通过从铜棒的原子吸收电子来排出。以下反应发生在阳极: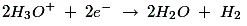
由于在铜电极处发生的还原反应,铜杆充满充电,因此它用作阳极。
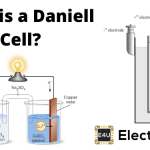
Daniell Cell.
的Daniell Cell.由一个装有硫酸铜溶液的铜容器组成。铜容器本身起正极的作用。在铜容器中放置一个含有稀硫酸的多孔锅。将一根汞齐的锌棒浸入硫酸中,充当负极。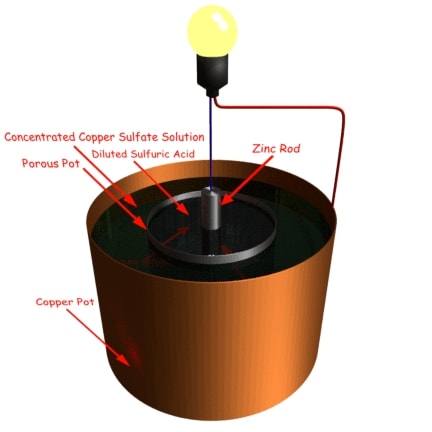
多孔坩埚中的稀硫酸与锌反应生成氢。反应过程如下: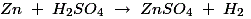
ZnSO的形成4在多孔罐中不影响细胞的工作直至ZnSO的晶体4存放。氢气通过多孔罐并与CUSO反应4解决方案如下: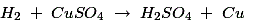
所形成的铜沉积在铜容器上。
电池的历史
在1936年夏季中旬,在伊拉克巴格达市附近建造了一条新的铁路线路时发现了一个古老的坟墓。在那个坟墓中发现的遗物约为2000岁。在这些遗物中,有一些粘土瓶子在顶部密封,间距。由由包裹铜板制成的圆柱形管围绕的铁棒从该密封的顶部突出。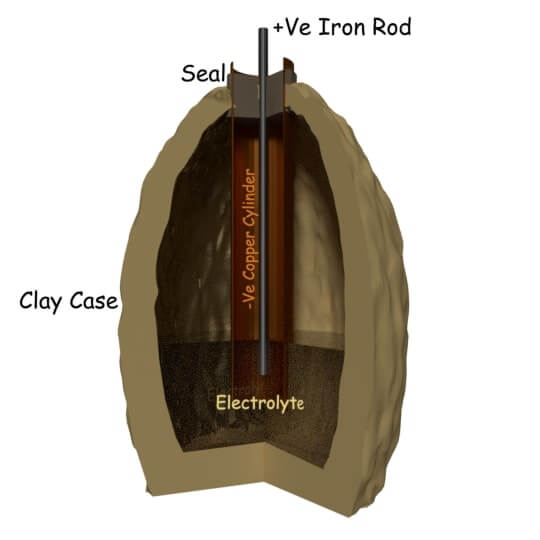
当发现者将这些罐子装满酸性液体时,他们发现铁和铜之间有大约2伏特的电位差。这些陶罐被怀疑是2000年前的电池。他们把这个罐子命名为Parthian电池。
在1786年,意大利解剖学家和生理学家的路易吉戈尔夫尼感到惊讶地看到,当他用两个不同的金属触动死青蛙腿时,腿的肌肉收缩。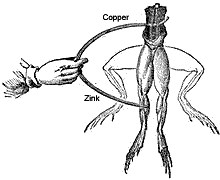
他无法理解真正的原因,否则他就会被认为是电池的第一个发明者。他认为这种反应可能是由于组织的特性。

之后,Alessandro Volta在浸泡在盐水而不是青蛙腿上的纸板上实现了相同的现象。他夹着一张铜盘和锌圆盘,用一块纸板浸泡在盐水中,并发现了一个po突出差异在铜和锌之间。
之后,在1800年之后,他开发了由在它们之间浸泡在盐水中的交替铜和锌圆盘构成的第一个伏特·电池(电池)。该系统可以产生可测量的电流。我们认为Alessandro Volta的Voltaic桩作为第一个“湿式电池单元”。就这样电池的历史开始了。从那时起直到今天,电池仍然是一个更好的选择的电力来源。在我们的许多日常生活中。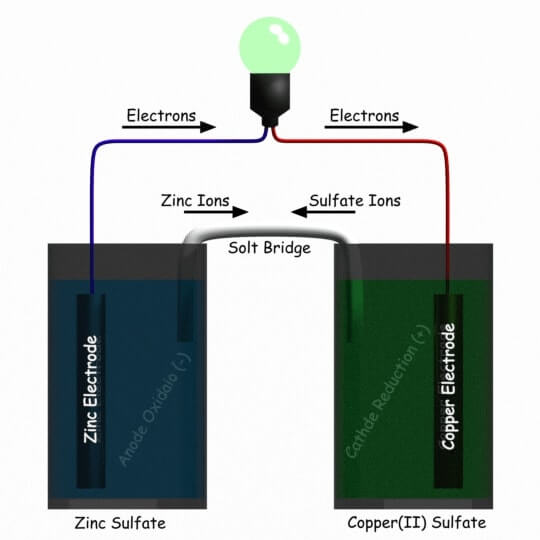
电流堆的主要问题是不能长时间地提供电流。1836年,英国发明家约翰·丹尼尔解决了这个问题。他发明了一种更先进的电池,被称为Daniell Cell.。约翰·丹尼尔将一根锌棒浸入一个容器中的硫酸锌中,将一根铜棒浸入另一个容器中的硫酸铜(II)中。
一个U形盐桥连接着这两个容器的解决方案。一个丹尼尔电池可以产生1.1伏特,这种类型的电池比伏打堆持续更长的时间。1839年,科学家、发现者威廉·罗伯特·格罗夫爵士设计了燃料电池。他将氢和氧混合在电解质溶液中,产生了电和水。燃料电池并没有提供足够的能量,但它是有帮助的。本生(1842年)和格罗夫(1839年)改进了使用液体电极供电的电池。

1859年,加斯顿植物;首先开发了铅酸电池。铅酸电池是一种可再充电二次电池的一种形式。铅酸电池仍用于许多工业用途。它仍然是最受欢迎的用作汽车电池。1866年,法国工程师Georges Leclanche开发了一种新的电池。它是一种被称为碳 - 锌湿纤维电池leclanche细胞。
与少数碳混合的碎锰二氧化碳形成正极和作为负极的锌棒形。他使用氯化铵溶液作为液体电解质。经过多年的几年,乔治LeClanche本身通过用氯化铵替代液氯化铵溶液来改善他的设计。
因此,他发明了第一个干电池。1901年,托马斯·阿尔瓦·爱迪生发现了碱性蓄电池。托马斯·爱迪生的电池以铁为正极材料(-),以氧化镍为负极材料(+)。以上内容只是无穷无尽的一部分电池的历史。
一步一步开发电池史
| 开发人员/发明家 | 国家 | 一年 | 发明 |
| Luigi Galvani. | 意大利 | 1786 | 动物电 |
| 伏打 | 意大利 | 1800 | 伏打电堆 |
| John F. Daniell. | 英国 | 1836年 | Daniell Cell. |
| 威廉罗伯特·格罗夫爵士 | 英国 | 1839年 | 燃料电池 |
| 罗伯特·芬森 | 德语 | 1842年 | 使用液体电极供电 |
| Gaston Plante. | 法国 | 1859年 | 铅酸蓄电池 |
| Georges Leclanche. | 法国 | 1866年 | leclanche细胞 |
| 托马斯阿尔瓦爱迪生 | 美国 | 1901 | 碱性蓄电池 |