的量子数基本上表示原子中电子的地址。这些量子数代表了原子中电子的位置、能级和自旋。这些量子数在表示电子构型时很有用。量子数有四种类型-
- 主量子数(n)
- 轨道或方位量子数(l)
- 磁量子数(m或ml)
- 自旋磁量子数(m年代)
主量子数(n)
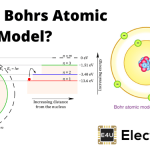
电子的主量子数表示电子所属的主要能级或壳层或轨道。它由“n”表示。它的整数值是1 2 3 4 ......等等。玻尔和夏季场原子模型采用了主量子数。
具有主量子数的电子,具有相同的能级(壳层)。这些能级用字母K, L, M, N, .......表示等。对于不同能级(壳层),“主量子数n”和与不同能级相关联的最大电子数见下表-
| Sl。不。 | 能级或轨道(壳) | 主量子数n | 最大电子数(2n2) |
| 1 | K | 1 | 2×12= 2 |
| 2 | l | 2 | 2×22= 8 |
| 3. | 米 | 3. | 2×32= 18 |
| 4 | N | 4 | 2×42= 32 |
随着量子数壳体的距离增大,壳体的距离增大。因此,两壳层具有不同的能级,能级随量子数的增加而减小。
轨道或方位角量子数(l)
轨道或方位角量子数表示与电子相联系的轨道的亚壳层。每个主壳层(能级)又细分为子能级/亚壳层。
这些亚层也叫做轨道。这些亚层轨道用s, p, d, f来表示,.......等,对应的轨道量子数l = 1,2,3,4 ......等。任何主壳层的亚壳数都等于主量子数n。任何主电子层的容量都可以通过增加亚电子层的电子容量来确定。子壳的容量见下表-
| Sl。不。 | 亚层 | 量子数(左) | 亚电子层2(2l + 1)的电子容量 |
| 1 | 年代 | 1 | 2(2×0 + 1)=2 |
| 2 | p | 2 | 2(2×1 + 1)=6 |
| 3. | d | 3. | 2(2×2 + 1)=10 |
| 4 | f | 4 | 2(2×3 + 1)=14 |
轨道或方位角量子数表示与电子相关联的角动量和可能的轨道形状。例如:对于轨道量子数l = 0,角动量值为零,轨道形状为直线,角动量为零。当l = 1时,轨道的形状是具有非零角动量的椭圆。当l = 2时,轨道形状为更圆的椭圆,角动量值较大。
对于不同的轨道或方位角量子数,轨道的形状如下表-所示
在电子排布中,主电子量子数就在字母前面表示,具有相同轨道量子数的电子数用字母的上标表示。例如:如果一个原子有6个电子,主量子数为2,在p的亚壳层。那么在电子排布中,它将被标记为2p6”。
磁量子数(m或ml)
磁量子数(ml)表示给定亚壳层的轨道。对于l的给定值,磁性的值量子数(ml)的范围为- l到+ l。例如,对于p-subshell, m的值l将,米l= - 1,0, + 1。轨道用p表示xpy和pz。式中,下标表示旋转轴的方向。对于给定的l值,m有2l + 1个可能的值l。主量子数为n的壳层有n2能级中的轨道。对于亚壳层,可能的轨道和磁的数量量子数在下表中给出-
| 亚层 | 轨道或方位量子数(l) | 数量的轨道 3 l + 1 |
磁量子数(m或ml) |
| 年代 | 0 | 1 | 0 |
| p | 1 | 3 (pxpypz) | -1 0 + 1 |
| d | 2 | 5 (dx2可能是2dz2dxydxzdyz) | - 2 -1 0 + 1 + 2 |
| f | 3. | 7 (fz3.fxz2fxyzfx (x23 y2)fyz2fz (x2可能是2)fy (3 x2可能是2)) | -3 - 2 - 1 0 + 1 + 2 + 3 |
自旋磁量子数(m年代)
正如地球绕着太阳公转,又绕着自己的轴自转一样,原子中的电子也绕着原子核公转,又绕着自己的轴自转,这叫做电子的“自旋”。电子绕其轴旋转(自旋)的方向用“自旋磁量子数”表示。这量子数不影响电子的能级。“自旋磁量子数”只能有一个值,即+ 1/2或- 1/2。一般来说,带m的电子年代= + 1/2的电子叫做,m的电子年代= - 1/2,叫做电子。没有两个成对的电子具有相同的自旋值。