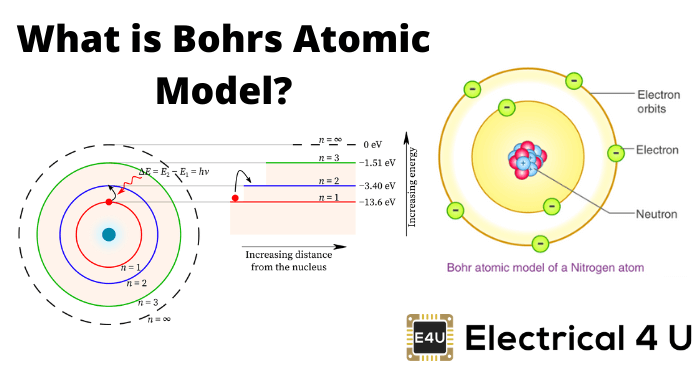
它是由丹麦物理学家尼尔斯·玻尔在1913年提出的。根据这个模型原子由中心的小核和绕着核的圆形轨道旋转的电子组成-类似太阳系。但是在这里,引力是由静电力提供的,而不是引力。原子核带正电荷,电子带负电荷。尼尔斯·玻尔进一步说明了带正电荷的原子核由质子和中子组成。质子带正电荷,中子不带任何电荷。尼尔斯·玻尔引入量子理论来克服量子理论的缺点卢瑟福的原子模型。根据这个理论——
- 电子按一定的轨道绕着原子核旋转。每个轨道都有一定的能级。这些轨道称为静止轨道。靠近原子核的轨道具有较低的能级,外层轨道具有较高的能级。电子可以在一定能级内旋转而不失去任何能量。加上能量原子,电子跃迁到更高能级的轨道。
另一方面,当电子从高能层轨道跃迁到低能层轨道时,电子以小包的形式释放能量。这些小的包叫做广达电脑或光子。光子的能量由,
- 带正电荷的原子核与带负电荷的电子之间因静电吸引而产生的向心力,与沿圆形轨道运动的电子的离心力相等。
- 电子在圆形轨道上运动的角动量,是的整数倍

其中,n是一个整数量子数。 - 轨道半径与n成正比2而电子的速度与n成反比。这些假设导致的结果已被证实是正确的,有待检验。
在那里,
h是木板的常数,
‘υ’是光的频率(在Hz),
“c”是光速,单位是m/秒,
λ是光发射的波长(单位:米)。

这个模型也有一些不足之处,列举如下-
- 它适用于一个电子原子,即氢原子。它不能轻易地扩展到解释更复杂的原子。
- 对于电子从一个轨道到另一个轨道的跃迁,它没有给出任何规则或限制。
- 它只引入了一个量子数n,而关于谱线精细结构的实验证据表明,增加的量子数越多。
- 化学键的定量解释不能用玻尔的原子模型。