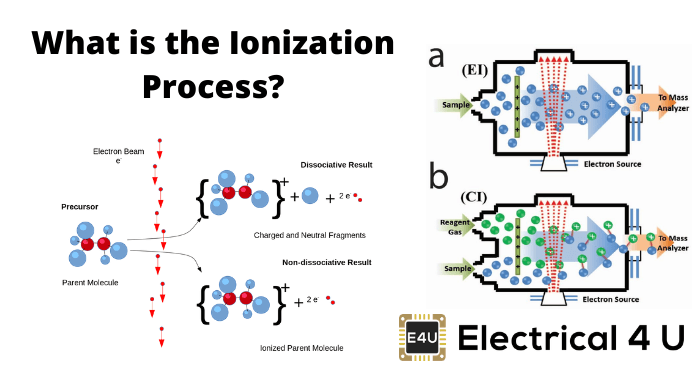
什么是电离?
电离(或离子化)定义为原子或分子通过获得或损失电子来获取正或负电荷,通常与其他化学变化结合。电离后,所得的带电原子或分子称为离子。
当将特定化学物质添加到水中时 - 例如,氯化钠(NaCl) - 它们被溶解,并且它们的分子被分成阴性和正离子。
将该分子分解成溶液中的正离子和负离子的该方法称为电离过程。
离子化的过程在下一步骤中断。
什么是电离过程?
要了解电离过程,我们将考虑氯化钠(NaCl)的结构。氯化钠是常见的盐,我们在日常生活中使用。
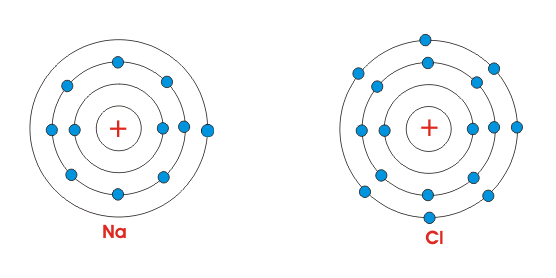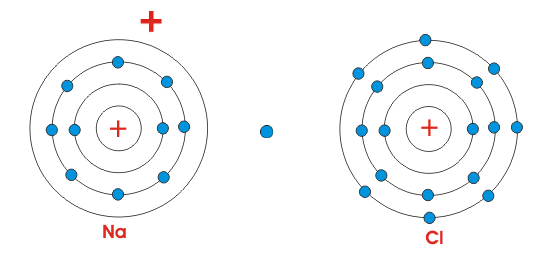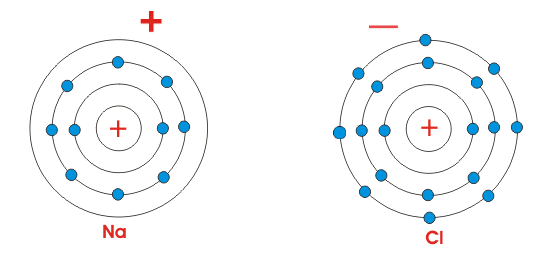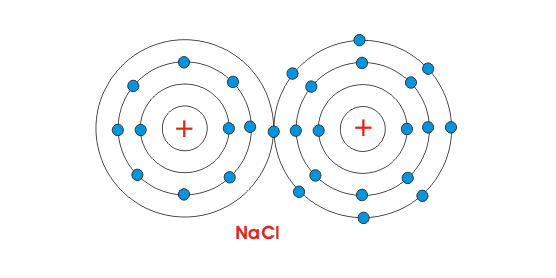
Na和Cl的原子序数分别为11和17。
这意味着钠原子具有11个电子,氯原子具有17个电子轨道。
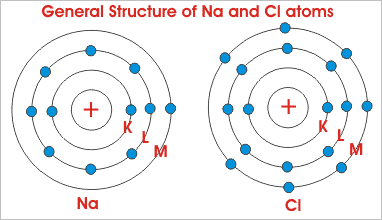
该原子结构或者这些电子的布置如下图所示。
如上所述,NA原子(图的左侧)在其最外面的轨道中只有一个电子。
虽然氯(图的右侧)在其最外面的轨道中含有七个电子。
保持稳定,原子通常在最外面的轨道中需要八个电子。
所以,显示的原子都是“不稳定”(也称为“化学活性”)。
当将这两个原子置于一起时,Na原子失去其最外电子并变得带正电(因为现在它具有比电子更高的质子)。
相反,CL原子获得了一个电子并变得带负电(因为现在它具有比质子更多的电子)。
因此,通过交换这些电子,原子在最外面的轨道中获得八个电子。
由于Na原子被带正电,并且Cl原子被带负电,因此在它们之间作用的静电力,因为它们将在一起并制备一个NaCl分子。
根据库仑的法律,作用在两个相反电荷之间的静电力表示为:
其中ε.R.是介质的相对介质。
因此,两个电荷之间的静电力与放置电荷的介质的相对介电常数成反比。
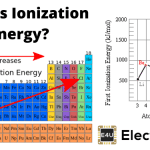
该电离过程可以通过介质的相对介电常数轻松解释。空气的相对介电常数为1.00058986±0.00000050或1,并在20时的相对介电常数O.C是80。
因此,在水中,作用在Na和Cl之间的静电力比空气中的80倍小。
Na和Cl之间的静电力变得如此小,使得难以将Na和Cl保持在水中。
这就是为什么每当NaCl(氯化钠)溶解在水中时,它的分子也分裂到阳性Na离子和负Cl离子中 - 即使在室温下或低于室温。
这是电离NaCl的过程。
电离过程 - 在视频上解释
对于那些更喜欢视频解释的人来说,下面的视频解释了什么是氯化钠的电离和电离过程。